行業動態
突破性療法三年回顧:數據分析與趨勢展望
作者: 來源:神宇醫藥 日期:2015-09-09 10:15:00
醫藥網9月9日訊 三年前的2012年7月,FDA制訂了“突破性療法指定”,作為促進與加快對治療嚴重病癥和未滿足醫療需的產品進行開發和審查的補充方案。
雖然突破性療法指定傳達了與快速通道(Fast Track)、優先審評(Priority Review)、加速批準(Accelerated Approval)類似的功能。不過,它需要大量更優異的的臨床改善證據,并需在整個臨床試驗過程中與FDA就開發項目的非臨床和臨床資料、試驗設計與審評協調進行密集溝通。
迄今,突破性療法指定已經實施3年,其對各個藥物市場的競爭態勢產生怎樣的影響?未來前景又將如何呢?
三年數據回顧與分析
獲得突破性療法指定的熱門適應癥藥物正在減少,需尋找高度未滿足需求的領域
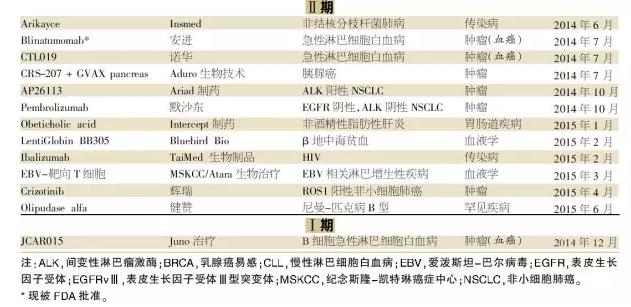
截至2015年6月,FDA藥品審評和研究中心(CDER)與生物制品審評和研究中心(CBER)共收到309份突破性療法指定請求。其中,29%已被授予,55%被拒絕,16%仍在等待中。該方案在過去的一年里,Ⅲ期項目的產品大部分已經被授予突破性療法指定。
已披露收到突破性療法指定的72只藥品中,63%(45只)屬于腫瘤學、血液學和罕見疾病適應癥。在這些適應癥中,作用新穎機制一直是關注的焦點。另一方面,心血管疾病、免疫學和內分泌學等藥物明顯缺乏。
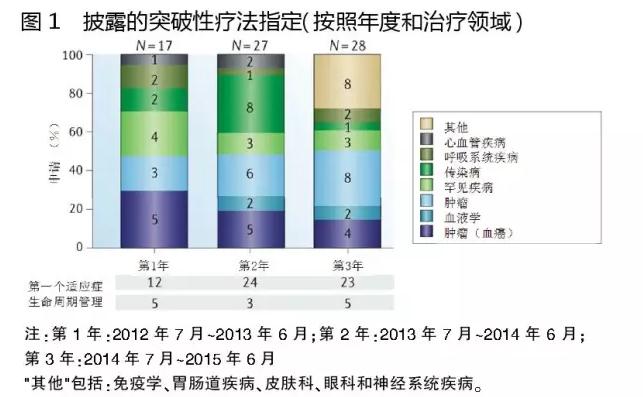
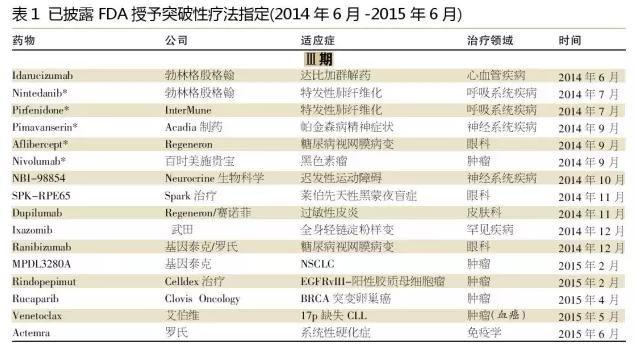
被授予突破性療法指定的優先適應癥,包括慢性淋巴細胞白血病(CLL)、囊性纖維化、丙型肝炎病毒感染和特發性肺纖維化。但是,在這些領域FDA授予突破性療法指定的藥物正在減少,似乎致力于使其資源放在特別高度未滿足需求的領域。
例如,在CLL領域中,2013~2014年,只有4只被授予突破性療法指定的新藥隨后獲得FDA的批準,包括2只CD20特異性單克隆抗體(mAb)——葛蘭素史克的ofatumumab和羅氏的obinutuzumab,2只靶向小分子藥物——Pharmacyclics/楊森的布魯頓酪氨酸激酶抑制劑ibrutinib和吉利德公司的磷酸肌醇3-激酶δ(PI3Kδ)抑制劑idelalisib。
另一方面,對其它一些適應癥,FDA突破性療法指定的藥物開始增加。例如,針對間變性淋巴瘤激酶(ALK)基因突變,已有幾只藥物獲得突破性療法指定,其中包括諾華的ceritinib,羅氏的alectinib和Ariad制藥公司的AP26113。
然而,Ariad制藥公司在2013年8月提出AP26113治療ALK陽性非小細胞肺癌治療的突破性療法指定初始申請,但因“相對較短的后續行動”和試驗中患者人群小而被拒絕。盡管AP26113已獲得有前途的數據,但并不優于ceritinib,ceritinib曾在2013年3月被授予突破性療法指定。雖然Ariad制藥公司最終在2014年10月獲得破性療法指定,但至今仍然沒有提交新藥申請。
新藥市場展望的指征
是否再次獲得突破性療法指定?加速上市的情況如何?對產品開發有何影響?
隨著制藥公司繼續專注于小規模患者群體的高價值機會,我們期待腫瘤學、血液學和罕見疾病適應癥能繼續成為未來突破性療法指定的一個主要部分。此外,我們期待更多的免疫學和中樞神經系統藥物被授予突破性療法指定。
在高度未滿足臨床需求的適應癥里,藥物似乎都能被授予突破性療法指定。突破性療法指定可能被認為是一個“門檻”,在該指定狀態下雖然可有效地競爭,但不利于新藥開發資源的分化。
然而,其他的例子表明,突破性療法指定將幫助新藥推向市場的速度提升,以及進入市場的順序改變。到目前為止,突破性療法指定的時間效應似乎是幾個月(而非幾年),從而導致在順序項的變化相對較少。
對于已被授予突破性療法指定藥物,追隨處于早期研究階段其他適應癥會否被再次授予突破性療法指定及其時間效應,以及對產品開發有什么影響,都是很有必要的。
例如,在多發性骨髓瘤領域,臨床開發階段各適應癥都授予突破性療法指定新藥至今只有2只:楊森/Genmab公司的CD38特異性單克隆抗體daratumumab,以及百時美施貴寶/艾伯維的CS1特異性單克隆抗體elotuzumab。
相比之下,千年制藥/武田的蛋白酶體抑制劑ixazomib、Array生物制藥的KSP抑制劑filanesib,以及賽諾菲處于Ⅰ期的CD38特異性單克隆抗體SAR650984,還沒有披露獲得突破性療法指定。雖然這些藥物可能已經獲得突破性療法指定,但沒有被公開。似乎獲得突破性療法指定需要經過時間考驗,以確定是否為高度未滿足需求的適應癥。
隨著突破性療法指定對新藥進入市場順序賦予的競爭優勢,制藥公司需要仔細監控突破性療法指定在每個適應癥和治療類別的影響。