行業動態
本土藥企、跨國藥企政策跟進能力大
作者: 來源:神宇醫藥 日期:2015-04-21 09:25:00
醫藥網4月21日訊 過去4年,國內企業對“特殊審批”、“重大專項”和“加快品種”三大通道的跟進度遠遠不及進口企業;但2015年第一季度,國產企業“特殊審批”受理號數量明顯提升。
國家無疑是鼓勵創新的,“重大專項”、“特殊審批”和“加快品種”三大通道正為創新藥“開快車”。
根據咸達數據V3.1,“重大專項”早在2005年就有相關受理號;2004年“特殊審批”有相關受理號,但再一次有“特殊審批”標簽的受理號就到2009年了;“加快品種”的受理號是從2010年開始的。
若統計2011~2014年三大通道的總受理號數,排名第一的是“特殊審批”,共914個;其次是“重大專項”,共168個;第三是“加快品種”,共147個(見圖1)。值得注意的是,2015年第一季度,咸達數據V3.1截止至2015年4月10日監測數據顯示,僅僅“特殊審批”就有相關注冊受理號80個,但“加快品種”和“重大專項”沒有受理號數據。

三大通道政策梳理
“特殊審批”
相對于申報生產的第三、四項,申報臨床的第一、二項的門檻明顯更低
“特殊審批”受理號數量那么多,或許與政策有相關。
按2009年1月7日頒布的《新藥注冊特殊審批管理辦法》,享受特殊審批特殊待遇的藥品有4種情形:一是未在國內上市銷售的從植物、動物、礦物等物質中提取的有效成份及其制劑,新發現的藥材及其制劑;二是未在國內外獲準上市的化學原料藥及其制劑、生物制品;三是治療艾滋病、惡性腫瘤、罕見病等疾病且具有明顯臨床治療優勢的新藥;四是治療尚無有效治療手段的疾病的新藥。其中主治病證未在國家批準的中成藥“功能主治”中收載的新藥,可以視為尚無有效治療手段的疾病的新藥。
屬于一、二項情形的,藥品注冊申請人可以在提交新藥臨床試驗申請時提出特殊審批的申請,CDE應在收到特殊審批申請后5日內進行審查確定;屬于三、四項情形的,申請人在申報生產時方可提出特殊審批的申請,CDE應在收到特殊審批申請后20日內組織專家會議進行審查確定。
相對于申報生產第三、四項,申報臨床的第一、二項的門檻明顯更低。2011~2014年,“特殊審批”申請注冊號中,申報臨床的有848個受理號,占比為92.8%,而申報生產的受理號僅為52個,補充的有14個,臨床與生產報批的比例達到16:1。
“重大專項”
主要針對10類重大疾病,化學藥、中藥、生物藥有各自的重點方向
重大新藥創新專項屬于國家重大科技專項,一向由衛計委推動,“十二五”期間任務是研制30個創新藥物,改造200個左右藥物大品種。2015年的重大新藥創制科技重大專項,重點針對嚴重危害我國人民健康的惡性腫瘤、心腦血管疾病、神經退行性疾病、精神性疾病、糖尿病、自身免疫性疾病、耐藥性病原菌感染、肺結核、重大病毒感染性疾病以及其他常見病和多發病(呼吸系統和消化系統疾病等)等10類(種)重大疾病。
其中,化學藥主要針對神經精神系統疾病(BACE、AMPA等靶點)、代謝系統疾病(PCSK9等靶點)、腫瘤靶向及免疫治療(WNT、PI3K-AKT-mTOR、c-Met、PD1、PD-L1、CTLA4、miRNA等靶點)、肺動脈高壓及慢性阻塞性肺病(sGC等靶點)等新機制和新靶點。
中藥則重點支持開展臨床優勢突出的創新中藥的臨床研究(近3年內獲得臨床試驗批件,并已開展臨床研究)。
生物藥重點支持新結構抗體、雙特異抗體、抗體偶聯藥物、全新結構蛋白及多肽藥物、生物類似藥;具備新技術、新工藝制備的新型疫苗、聯合疫苗及治療疫苗等,具備較好成藥性的創新品種。
目前暫無相關政策發布,從CDE標記有“加快品種”的產品看,疫苗占較大比例
至于“加快品種”,目前暫無相關政策發布。“加快品種”的政策主要是推進臨床亟需仿制藥優先審評制度建設。傳說中有62個仿制藥進行優先審評,但究竟是哪62個還是云里霧里。
從目前CDE標記有“加快品種”的產品來看,疫苗占了較大比例,如脊髓灰質炎相關疫苗、H7N9流感病毒相關疫苗、十三價肺炎球菌疫苗、麻疹疫苗、風疹疫苗等。
政策跟進能力PK
進口企業VS國內企業
三大通道吻合度:諾華NO.1,恒瑞NO.2,輝瑞NO.3
那么,“重大專項”、“特殊審批”和“加快品種”的注冊受理號是否都屬于國產廠家呢?
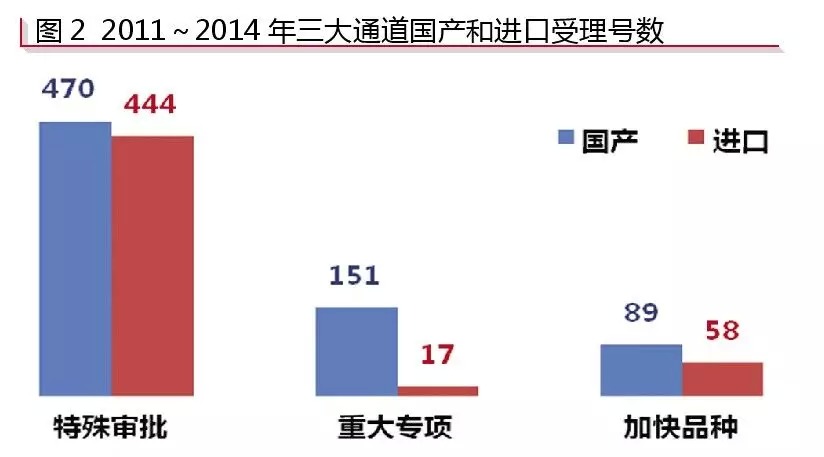
根據咸達數據V3.1的監測,“特殊審批”中,進口藥品注冊申報的較多,占比為48.58%,共444條受理號,其中97.97%為申報臨床;“特殊審批”中,申報生產的國產受理號與進口受理號之比約為5:1;“加快品種”中,國產受理號與進口受理號之比為89:59;“重大專項”則更偏向于國產受理號,國產受理號與進口受理號的比約為9:1(見圖2)。
一家企業如果能夠非常嫻熟地運用“重大專項”、“特殊審批”和“加快品種”等政策去申報注冊產品,雖然未必能代表其創新能力,但一定能說明其非常適應國家的創新藥鼓勵政策。

如表1所示,三大通道受理號最多的生產企業是諾華,其次是恒瑞,第三位是輝瑞。前十一排名中,5個是國產企業,6個是進口企業。若不考慮“特殊審批”申報臨床的數據,那么排名第一的是恒瑞,其次是豪森和天壇生物,第三是拜耳。
以上數據表明,實際響應國內創新藥政策的國內企業并不多。相較于國內企業,國外企業更積極去適應國內的新藥政策,以使自己的產品盡快上市。
國內企業開始覺醒
一季度,國內企業“特殊審批”提速,是進口企業的4倍
2011~2014年,恒瑞的受理號(除備案)共346條,屬于三大通道的受理號共63條,占整體受理號數的18.21%;豪森的受理號(除備案)共299條,屬于三大通道的受理號共63條,占整體受理號數的17.72%。
相較而言,同期科倫的受理號(除備案)共635條,但只有2個受理號屬于“特殊審批”,且申報的是臨床,尚無“重大專項”和“加快品種”的受理號。齊魯受理號數為448條,有8個受理號屬于“特殊審批”的臨床申請,亦無“重大專項”和“加快品種”的受理號。科倫的申報受理號數是恒瑞的1.8倍,但恒瑞在三大通道的受理號數是科倫的32倍。
最近傳聞,藥品審批速度要加快了,以往積壓的藥品注冊申請問題有望3年解決。假如產品批文獲批速度加快,那么接下來就要開始面對多家生產企業的藥品招標議價降價問題。在一眾政策山雨欲來風滿樓的層層壓力之下,國內生產企業越來越關注創新藥及其配套政策。
過去4年,國內生產企業實際申報的產品與國家三大通道政策的吻合度,遠遠不及進口企業。國內企業申報產品的策略更傾向于市場策略,應付招標政策。
可喜的是,國內企業已認識到變革迫在眉梢。2015年第一季度,國產企業“特殊審批”受理號數量是進口企業的4倍,這或許是我國創新藥春天到來的一個信號。
提問:
國內完全自主研發的創新藥有多少?
根據咸達數據V3.1,2014年1.1類化藥9個受理號獲批生產,涉及4個化學通用名,其中包括“阿德福韋酯”;3.1類化藥70個受理號獲批生產,5類26條,6類222條。2013年,1.1類獲批的新藥化藥受理號有4個,涉及2個化學通用名,也包括“阿德福韋酯”,還有“帕拉米韋三水合物”;同年3.1類化藥獲批受理號95條,5類25條,6類223條。
若按照真正意義上的新化合物是我國自主研發才算創新藥,那么我國的創新藥和仿制藥的比例恐怕會遠低于1:100。